

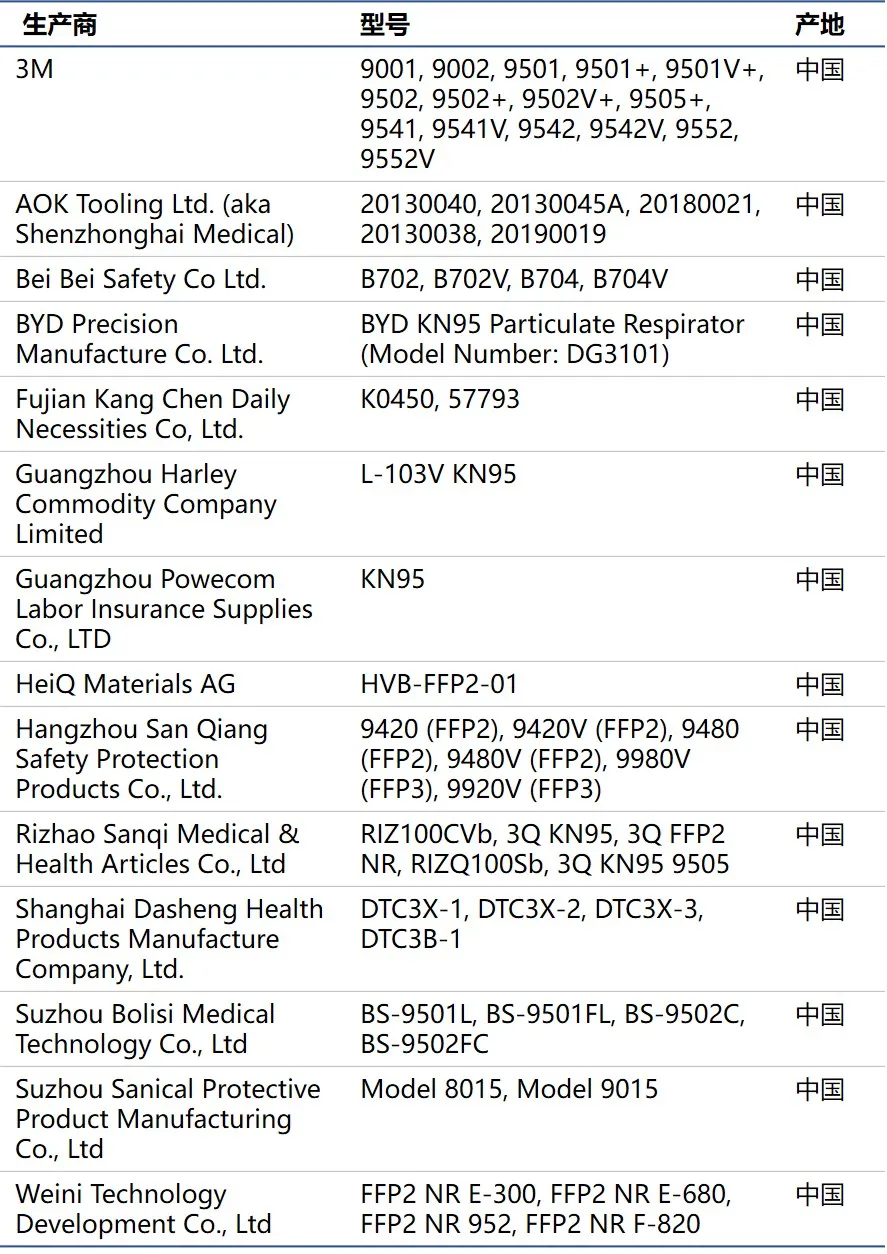
5月8日消息,本周四,美國食品監督管理局(FDA)以性能不合格為由(中國制造KN95口罩過濾顆粒物質不到95%),撤銷了中國多家口罩制造商的EUA授權。目前,該批準企業數量從86家銳減剩14家。
由于供應短缺,美國已從上個月開始從中國購買N95口罩。同樣在星期四,FDA還表示已經向涉嫌兜售假冒甚至是危險的新冠治療方案的公司發出了42封警告信。
據了解,今年4月3日,監管機構對未經NIOSH批準的中國呼吸器發布了緊急使用授權書,允許從86家公司進口。根據該命令,如果公司在中國以外的司法管轄區獲得監管部門的批準(可以通過FDA進行驗證),或者可以提供來自公認的獨立測試實驗室的測試報告(可以通過美國監管機構進行驗證),則可以將呼吸器出口到美國。如果制造商在45天內將其產品提交給NIOSH進行測試,則從FDA批準的呼吸器清單中剔除的制造商都有資格重新使用。
FDA 今日重新發布了 EUA,除允許進口名單(附后)大大縮短外 , 還做了以下修訂:
1、修訂資格標準,允許根據對獨立實驗室檢測記錄的標準的可接受的性能進行授權;
2、取消進口商申請 EUA 的能力 , 并指示制造商提供授權進口商的清單;
3、增加對中國國家藥品監督管理局(NMPA)注冊證書的認可,由 FDA 進行核實。
這三個新標準解讀出來就是:
如果你還沒有申請成功過EUA,請用NIOSH證,或者其他國家的相應的認證,FDA可以認可的包括EN149 CE證等等。如果你曾經在EUA上面但是現在被取消了,一定要在四十五天以內拿到NIOSH 正式的呼吸效率測試(標準的NIOSH測試之一)或者是做CDC版本的簡化版(和CDC抽查的測試一致),并且結果都在>95以上。
碰一鼻子灰的除了被撤銷EUA權限的中國制造商外,比亞迪也面臨著被迫退款2.47億,或面臨5.05億損失的局面。據悉,美國當地時間5月6日,加州州長加文·紐森周三表示,該州向中國比亞迪公司訂購的價值約10億美元的口罩中,已有數千萬個外科口罩運達,但數百萬個原定本周運達的N95口罩因為聯邦認證過程中的問題而被延誤了。
加州緊急事務辦公室表示,由于未能在4月30日截止日期前拿到認證,比亞迪將退還該州為一筆價值約10億美元的口罩合同支付的預付款的一半,即2.47億美元。
加州緊急事務辦公室表示,根據周三修訂的一項合同條款,比亞迪口罩獲得聯邦認證的截止日期將推遲至5月31日,如果屆時還不能拿到認證,比亞迪將退還另一半預付款。
以上內容屬作者個人觀點,不代表雨果網立場!本文經原作者授權轉載,轉載需經原作者授權同意。