

“醫療物資出口產地檢驗”事件一波三折。海關最新消息指出,按照72號文件要求,對于53號公告規定的11類(19個商品編碼)出口法檢醫療物資,采取的是驗證管理方式,意味著無需實施產地檢驗,報關時不需要出口電子底賬,企業正常申報報關單。
有業內人士指出,雖然目前實際操作中,仍是按照之前的正常申報,且不會被退單,但幾乎99%都會被查驗,出口通關審核趨嚴。
口罩等防疫物資資質梳理,美國和歐洲當地資質要求各異
據賣家爆料稱:“自上周開始,歐洲ECM認證機構已經停止接單,就連FDA也全面停止接單了。身邊已有同行口罩機都已準備就緒,非要安裝好后再進行申請認證,奈何機器安裝到一半認證通道卻關閉了,巧婦難為無米之炊。”
對此,深圳合眾商務咨詢有限公司副總經理張劍表示,盡管當前海關公告明確指出醫療物資出口無需實施產地檢驗,但出口企業切忌掉以輕心,不排除未來醫用口罩等防疫物資會被列為出口法檢的可能。因此,建議出口企業應積極準備法檢合規產品,對接合規且有資質的廠家,如果是手頭仍有庫存的情況下,則盡快將產品發往海外才是明智之舉。
據介紹,從事口罩等防疫物資的出口企業,應在口岸報關前向生產地、組貨地海關提出申請,且滿足產品生產和發貨地資質要求,以及產品銷售地資質要求。
1、產品的生產和發貨地資質要求:主要包括海關出口、行業政府監管,以及工廠出廠生產這三點。
以口罩出口為例,包括如下幾點:
(1)生產廠家需要提供有第三方檢測機構提供的口罩產品檢測報告;
(2)行業監管要求,需要銷售口罩的公司具備醫療器械產品銷售資質,口罩等一般防疫物資需要申請國內二類醫療備案許可資質;
(3)海關要求,銷售口罩的公司要具備貨物出口權資質。
2、產品的銷售地資質要求
其一、美國當地。
目前,美國當地的行業監管及海關監管,需要對防疫物資具備FDA資質認證才可以進口清關。
那么,美國FDA認證需要具備哪些條件呢?目前,美國對口罩認證分為兩種,一種是需要注冊一類FDA認證的防護口罩;另一種是需要二類FDA認證的醫用口罩。
張劍表示,通常情況下二類FDA認證時間長達十個月,且注冊費用昂貴接近20萬人民幣,國內真正意義上申請二類FDA認證的醫用口罩出口企業屈指可數。另有官網數據顯示,最近三年中國企業獲得美國FDA二類認證的企業是個位數。
“目前大多數企業的做法是把防護口罩和符合醫用標準的醫用口罩都只能按照防護類口罩申請一類FDA認證,這就導致KN95口罩(屬于醫用口罩)在清關時被抽查容易觸發潛在風險。口罩是醫用標準還是防護標準,只能在國內采購時與廠家或是供應商確定好產品規格,目前大家的做法就是把防護口罩和醫用口罩都在FDA一類防護口罩申請認證資質,現在國內幾乎是找不到具備FDA二類認證的工廠廠家。”他透露。
其二、歐洲當地。
歐洲口罩等防疫產品需要具備CE認證,CE認證對口罩也分為防護口罩和醫用口罩兩種。就目前來看,國內的商家通常申請的大多數是CE防護口罩認證資質,防護等級FFP2,執行標準EN149-2009。
據張劍介紹,中國賣家申請CE認證,需要具備在歐洲當地的認證機構遞交認證申請,可以自由選擇認證機構。而如果在國內申請CE認證,只能通過當地機構授權給國內認證機構的機構才可以申請成功。“目前尚無可定論哪家機構的證書是真實有效,每一份CE證書會對應一份產品檢測報告,沒有檢測報告的CE證書將面臨巨大的商業風險和法律風險。”
除此之外,針對CE在歐洲清關貨物被扣的問題。一位不具名的資深物流服務人士坦言,當前跨境服務市場魚龍混雜,不排除會有部分不專業且不負責任的企業會把防護口罩申報和醫用口罩申報混為一談,打著口罩檢測報告名義進行清關,最終導致被海關查驗扣貨。他強調,“尤其是從事口罩等防疫物資的出口企業,凡是提供有效的CE認證,不要輕易在清關時申報高規格口罩標準,確保口罩產品品質有保障,才能大大降低產品被扣貨的幾率。”
海關53號文件“余震”,外貿B2B和跨境B2C如何對癥下藥?
“外貿B2B和跨境B2C對于醫用口罩等防疫物資出口具備資質實際上大有不同,這往往也是出口企業容易忽視之處。”張劍分析道,一種是外貿B2B的企業通常都會有自己的進出口權公司,具備貨物進出口資質,公司的貨物出口是采用自己的進出口權公司進行出口報關及出口退稅;另一種跨境B2C賣家,大部分是不做出口退稅,貨物出口清關主要是外包交由專業FBA頭程公司一站式解決,支付相應運費即可。僅有少數賣家會做小部分出口退稅,這類賣家中還有一部分是用物流公司的資質做出口退稅的情況,實則擁有進出口資質的公司少之又少。
隨著海關53號文件出臺,不同類型出口企業面臨的難題各異。“一方面,對于已經擁有貨物進出口資質的外貿B2B企業,只需要在原來的基礎上,增加海關產品檢驗檢疫資質備案申請,申請國內二類醫療備案銷售許可資質。上游供應商提供第三方權威機構出具的產品檢測報告,只要產品品質符合相關要求即可符合海關最新的出口條件了;另一方面,大多數跨境B2C賣家不具備貨物進出口權的資質,有的賣家用自己不具備貨物進出口權的公司申請了國內二類醫療備案許可。”他說。
卓志跨境電商總裁李金玲也針對醫療物資出口,通關單填報的注意事項提出如下幾點:
1、領證機關:企業申請電子底賬的屬地海關代碼;
2、品名,商品編碼,品牌,型號,成交單位,成交數量,貨物總值保持與報關資料一致;
3、通關單信息中的境內發貨人、運抵國、項數、次序與報關信息確保一致;
4、出口貨物報關單上的“申報日期”必須在出境貨物通關單的有效期內。需要注意的是,目前申報系統已升級,通關單數量和項數要與報關單一致,否則將無法通過審核。
根據商務部、海關總署、國家藥品監督管理局發布的2020年第5號最新公告指出,自4月1日起,出口新型冠狀病毒檢測試劑、醫用口罩、醫用防護服、呼吸機、紅外體溫計的企業向海關報關時,須提供書面或電子聲明(模版如下圖所示),承諾出口產品已取得中國醫療器械產品注冊證書,從而符合進口國(地區)的質量標準要求。海關將憑藥品監督管理部門批準的醫療器械產品注冊證書驗放。
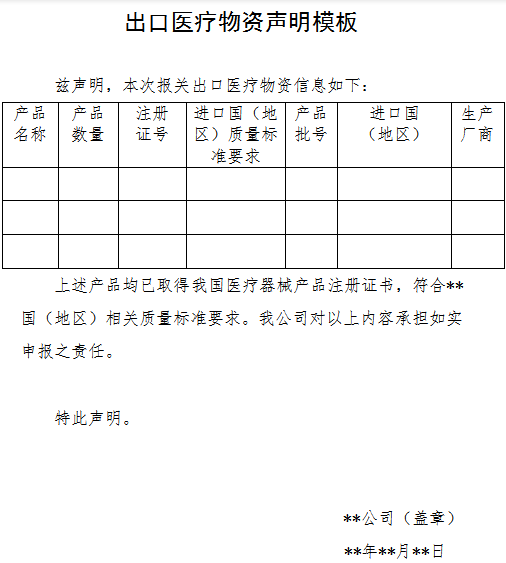
(出口醫療物資聲明模版截圖)
最后,張劍總結道:“不論口罩是否需要檢驗,這對于從事口罩等防疫物資的企業來說,當務之急是盡快有一家自己的公司,具備貨物進出口權資質,獲得海關檢驗檢疫備案許可,申請國內二類醫療器械銷售許可。與此同時,出口產品品質應當符合相關行業標準,產品具備國內第三方權威檢測機構出具的產品檢測報告,未雨綢繆做好萬全準備,以不變應萬變。”
(文/雨果網 陳林)
【特別聲明】未經許可同意,任何個人或組織不得復制、轉載、或以其他方式使用本網站內容。轉載請聯系:editor@cifnews.com
相關閱讀推薦: