


周五經(jīng)歷了一波三折的醫(yī)療物資出口商檢“大戰(zhàn)”,原以為會因為海關(guān)總屬發(fā)布的53號公告塵埃落定,沒想到又再次反轉(zhuǎn)。
讓我們來回顧一下此次醫(yī)療物資出口商檢變化過程:
4月10日凌晨00:01,海關(guān)系統(tǒng)更新,對19個商品編碼項下的醫(yī)療物資實施出口法檢。
4月10日早上8點(diǎn),海關(guān)系統(tǒng)撤銷法檢要求。
4月10日中午12點(diǎn),海關(guān)總署發(fā)布53號公告,對11個商品編碼下的醫(yī)療物資實施出口商品檢驗。
4月11日,海關(guān)發(fā)布緊急通知,對于53號公告的具體操做出了新的解釋。
不同于其他出口法檢商品,此次53號公告新增法檢出口醫(yī)療物資采取的是驗證管理方式,無需實施產(chǎn)地檢驗,報關(guān)時無需出口電子底賬,企業(yè)只需正常申報報關(guān)單。
根據(jù)海關(guān)總署2020年第53號公告,自4月10日起,對“6307900010”等海關(guān)商品編號項下的11類醫(yī)療物資實施出口商品檢驗,共涉及19個HS編碼。之前,對出口檢測試劑已實施衛(wèi)生檢疫。
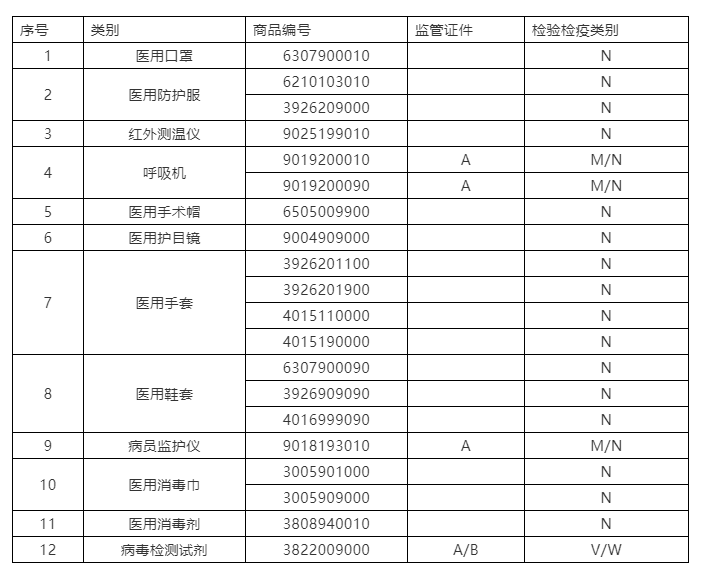
1、出口申報
對53號公告所列11類出口法檢醫(yī)療物資企業(yè)通過單一窗口申報報關(guān),不同于其他出口法檢商品的是,此次新增法檢出口醫(yī)療物資一般無需實施產(chǎn)地檢驗,報關(guān)時無需出口電子底賬。
(1)對出口法檢醫(yī)療物資,企業(yè)需在報關(guān)單商品名稱欄填報用途,并注明是否醫(yī)用,檢測試劑需注明是否為新型冠狀病毒檢測用。
溫馨提示:
同一HS編碼下既有醫(yī)療物資又有非醫(yī)療物資的,應(yīng)根據(jù)商品本身特征即生產(chǎn)制造標(biāo)準(zhǔn),確定是否醫(yī)用。
(2)對三部委“5號公告”所列(含公告后續(xù)調(diào)整所列)的出口新型冠狀病毒檢測試劑、醫(yī)用口罩、醫(yī)用防護(hù)服、呼吸機(jī)、紅外體溫計5類醫(yī)療物資,企業(yè)向海關(guān)報關(guān)時,須提供書面或電子聲明和我國醫(yī)療器械產(chǎn)品注冊證書。新冠病毒檢測試劑還須提供藥監(jiān)部門出具的出口銷售證明。
(3)對其他出口法檢醫(yī)療物資,企業(yè)向海關(guān)報關(guān)時,應(yīng)當(dāng)提供醫(yī)療器械產(chǎn)品注冊/備案證明和質(zhì)量安全承諾聲明。對無相關(guān)證明和承諾聲明的,海關(guān)將實施嚴(yán)密監(jiān)管。
(4)對新冠病毒檢測試劑,發(fā)貨人應(yīng)當(dāng)申請衛(wèi)生檢疫審批,憑《入/出境特殊物品衛(wèi)生檢疫審批單》通過單一窗口報檢,經(jīng)海關(guān)檢驗合格后,獲得電子底賬,報關(guān)時填寫電子底賬帳號。
鄭重提示:
企業(yè)必須按規(guī)定如實向海關(guān)申報,對將醫(yī)用物資偽報為非醫(yī)用物資的,依法從重處罰;涉嫌構(gòu)成犯罪的,移送地方公安機(jī)關(guān)追究刑事責(zé)任。
2、質(zhì)量安全要求
出口法檢醫(yī)療物資應(yīng)當(dāng)符合進(jìn)口國(地區(qū))的要求,對進(jìn)口國(地區(qū))無質(zhì)量安全標(biāo)準(zhǔn)要求的,應(yīng)當(dāng)符合我國質(zhì)量安全標(biāo)準(zhǔn)。
小工具
醫(yī)療物資國內(nèi)外質(zhì)量安全標(biāo)準(zhǔn)可登陸“海關(guān)總署網(wǎng)站—總署概況—商品檢驗司—政策法規(guī)”欄目查詢(不定期更新),訪問地址:http://sjs.customs.gov.cn/sjs/zcfg56/index.html
部分國家(地區(qū))防疫物資技術(shù)法規(guī)和標(biāo)準(zhǔn)要求(第三版),訪問地址:http://sjs.customs.gov.cn/sjs/zcfg56/2963129/index.html
我國和國外部分國家(地區(qū))防疫醫(yī)療物資質(zhì)量安全標(biāo)準(zhǔn)和主要項目(第一版),訪問地址:http://sjs.customs.gov.cn/sjs/zcfg56/2963129/index.html
3、裝運(yùn)前檢驗
按照中國和國外政府簽訂的雙邊協(xié)議,對出口至部分國家和地區(qū)的商品需申請實施裝運(yùn)前檢驗。

再次聲明:
企業(yè)是出口醫(yī)療物資質(zhì)量安全第一責(zé)任人,海關(guān)依法實施檢驗監(jiān)管。出口屬于摻雜摻假、以假充真、以次充好的商品或者以不合格進(jìn)出口商品冒充合格進(jìn)出口商品的,將依法依規(guī)嚴(yán)厲查處;構(gòu)成犯罪的,依法追究刑事責(zé)任。
《海關(guān)實施出口醫(yī)療物資法定檢驗工作方案》的通知(署監(jiān)發(fā)「2020」72號),內(nèi)容摘要及解讀如下:
按照72號文件要求,對于53號公告規(guī)定的11類(19個商品編碼)出口法檢醫(yī)療物資,采取的是驗證管理方式,就是不需要做商品品質(zhì)檢驗,無需出口電子底賬,企業(yè)正常申報報關(guān)單。
單證提交要求:在三部委發(fā)布的“5號公告”里的5類醫(yī)療物資,提交醫(yī)療器械產(chǎn)品注冊證和企業(yè)承諾聲明;在三部委發(fā)布的“5號公告”外的醫(yī)用物資,企業(yè)提交注冊證和質(zhì)量安全承諾書,非醫(yī)用物資不要求提交注冊證和質(zhì)量安全承諾書。
海關(guān)審核要求:三部委5號公告涉及5類醫(yī)療物資,而海關(guān)53號公告涉及11類醫(yī)療物資。其中,4類相同,7類不相同。但都是對于醫(yī)療物資的新措施,不是對于非醫(yī)療物資的新措施。所以,海關(guān)申報系統(tǒng)中并沒有對53號公告中的19個HS設(shè)置出口商檢監(jiān)管條件。海關(guān)采取電子審核加人工審單的方法,處理53號文件涉及的申報單證。涉及53號公告的出口防疫物資申報時,不需要電子底賬,數(shù)據(jù)不走ECIQ系統(tǒng)。
三部委5號公告的4類商品按5號公告要求辦理,需提供中國醫(yī)療器械產(chǎn)品注冊證和企業(yè)承諾說明書,不需要做產(chǎn)品法定檢驗。對53號公告新增的7類商品,綜合業(yè)務(wù)崗位幾乎100%人工審單,發(fā)現(xiàn)未放行的可以聯(lián)系海關(guān)審單部門。
對非醫(yī)用的,若沒被布控,直接放行;對醫(yī)用的,需企業(yè)提供注冊證書(可以是電子掃描件)及出口企業(yè)的質(zhì)量承諾書,有上傳的,原則上(被風(fēng)險布控或者綜合業(yè)務(wù)崗人工審單有疑問的、決定布控除外)予以放行,沒有上述注冊證書或者出口企業(yè)質(zhì)量保證承諾書的,將可能被布控。
查驗資料要求:如果產(chǎn)品涉及醫(yī)療物資,企業(yè)需提供注冊/備案證明和質(zhì)量安全承諾書。對于現(xiàn)場無法判定或企業(yè)提出異議的送實驗室檢測。72號文中明確了“在確定是否為醫(yī)療物資時,應(yīng)根據(jù)商品本身特征而非申報用途”。
出口醫(yī)療物資需要符合國內(nèi)出口標(biāo)準(zhǔn),同樣也需要遵循國外的進(jìn)口標(biāo)準(zhǔn)。

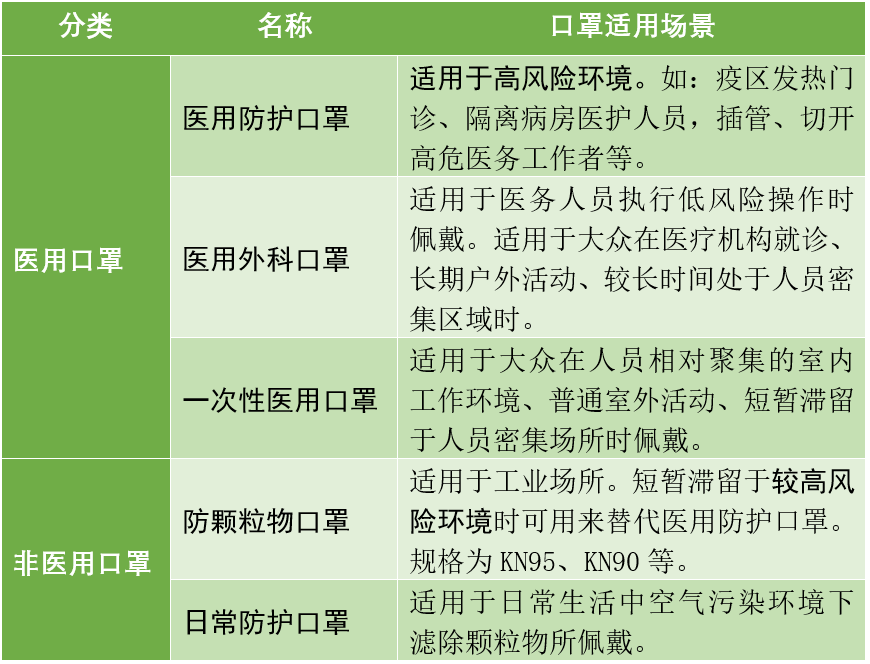
1、口罩的基本分類與細(xì)分
口罩從用途可以分為醫(yī)用/非醫(yī)用兩大類。顧名思義,醫(yī)用口罩主要用于醫(yī)療方面的防護(hù),可以細(xì)分為醫(yī)用防護(hù)、醫(yī)用外科、一次性醫(yī)用三種;非醫(yī)用口罩也被稱為個人防護(hù)口罩,可根據(jù)其適用場景,可細(xì)分為防顆粒物和日常防護(hù)兩種。不同用途的口罩其技術(shù)要求不同、適用范圍也不同。
中國主要的口罩分類
2、利用外觀與包裝信息區(qū)分醫(yī)用/非醫(yī)用口罩
通過口罩結(jié)構(gòu)區(qū)分
通過過濾閥分辨。帶過濾閥的口罩一般不會是醫(yī)用口罩。如中國醫(yī)用防護(hù)口罩標(biāo)準(zhǔn)GB 19803-2010 第4.3條款就明確規(guī)定“口罩不應(yīng)有呼氣閥”,這樣可避免飛沫、微生物等通過呼氣閥呼出,從而危害他人。而民用口罩允許有呼氣閥,通過呼氣閥可以減小呼氣阻力,從而有利于作業(yè)人員長時間工作。

通過外包裝上的信息分辨
正規(guī)途徑銷售的口罩產(chǎn)品的最小單元包裝上應(yīng)該有商品名稱、執(zhí)行的標(biāo)準(zhǔn)和防護(hù)等級等信息。這些商家明示的信息可以作為一個分辨點(diǎn),如商品名稱中帶有“醫(yī)用”或英文“surgical”“Medical”等字樣的,一般可判定為醫(yī)用口罩。

3、適用標(biāo)準(zhǔn)區(qū)分醫(yī)用/非醫(yī)用口罩
醫(yī)用口罩在不同國家/地區(qū)適用不同的標(biāo)準(zhǔn)和認(rèn)證要求,企業(yè)和個人可根據(jù)產(chǎn)品進(jìn)口國家/地區(qū),根據(jù)產(chǎn)品的適用標(biāo)準(zhǔn)進(jìn)行區(qū)分,產(chǎn)品適用標(biāo)準(zhǔn)和認(rèn)證信息可從產(chǎn)品外包裝或生產(chǎn)者提供的檢測報告或證書獲得。
出口美國
醫(yī)用口罩在美國屬于醫(yī)療器械,適用《醫(yī)用口罩材料性能標(biāo)準(zhǔn)規(guī)范》(ASTM F2100),由美國食品藥品監(jiān)督管理局(FDA)管理,須通過501K注冊或近期FDA公布的其它途徑,獲得工廠注冊和醫(yī)療器械列名后方可在美國上市。因此,輸往美國的口罩外包裝或檢測報告或證書上有上述內(nèi)容的,可被判定為醫(yī)用口罩。
出口美國非醫(yī)用口罩不屬2020年第5號公告范圍,但企業(yè)應(yīng)注意,產(chǎn)品需通過NIOSH注冊方可在美國上市。

出口歐盟
歐盟醫(yī)用/非醫(yī)用口罩均需加貼CE標(biāo)志,但適用標(biāo)準(zhǔn)不同。
醫(yī)用口罩在歐盟屬于I類器械,分為I類非無菌和無菌兩種,需按照歐盟醫(yī)療器械指令93/42/EEC(MDD)或歐盟醫(yī)療器械條例EU2017/745(MDR)加貼CE標(biāo)志,對應(yīng)的標(biāo)準(zhǔn)是EN14683,輸往歐盟的口罩外包裝或檢測報告、證書上有上述內(nèi)容的,可被判定為醫(yī)用口罩。

需要注意的是,根據(jù)口罩無菌/非無菌狀態(tài),歐盟采取不同的合格評定辦法,非無菌醫(yī)用口罩企業(yè)只需進(jìn)行CE自我符合性聲明,不需要通過公告機(jī)構(gòu)認(rèn)證。在準(zhǔn)備好相應(yīng)文件及測試報告等資料后,即可自行完成符合性聲明。無菌醫(yī)用口罩還必須由授權(quán)公告機(jī)構(gòu)進(jìn)行CE認(rèn)證。
出口歐盟非醫(yī)用口罩不屬于醫(yī)療器械,但需符合歐盟個人防護(hù)設(shè)備條例EU2016/425(PPE)要求,由授權(quán)公告機(jī)構(gòu)進(jìn)行CE認(rèn)證并頒發(fā)證書,對應(yīng)的標(biāo)準(zhǔn)是EN149。
出口其它國家和地區(qū)
輸往其它國家和地區(qū)口罩產(chǎn)品,可參考其提供的中國標(biāo)準(zhǔn)檢測證書與注冊備案信息進(jìn)行判斷,中國醫(yī)用口罩標(biāo)準(zhǔn)有三個,GB 19083-2010、YY 0469-2011、YY/T 0969-2013,使用這三個標(biāo)準(zhǔn)生產(chǎn)的口罩可被判定為醫(yī)用口罩。
中、美、歐三個國家或地區(qū)醫(yī)用口罩標(biāo)準(zhǔn)

4、通過政府注冊管控信息進(jìn)行區(qū)分
由于醫(yī)用口罩在大部分國家或地區(qū)都是按照醫(yī)療器械進(jìn)行注冊或管控的,消費(fèi)者可以進(jìn)一步通過相關(guān)注冊管控信息進(jìn)行分辨。下面以中、美、歐三個國家和地區(qū)舉例分析。
中國
醫(yī)用口罩在中國屬于二類醫(yī)療器械,是由省一級藥品監(jiān)管部門實施注冊管理,可以通過醫(yī)療器械查詢醫(yī)療器械準(zhǔn)入號進(jìn)行查詢。鏈接為:
http://www.nmpa.gov.cn/WS04/CL2590/
美國
已獲得美國FDA準(zhǔn)入的口罩產(chǎn)品可以通過其官網(wǎng)查詢注冊證書號進(jìn)行查詢,鏈接為:
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfPMN/pmn.cfm
另外根據(jù)FDA最新政策,目前是在滿足一定條件的情況下認(rèn)可中國標(biāo)準(zhǔn)的口罩,其授權(quán)企業(yè)的鏈接為:
https://www.fda.gov/media/136663/download
歐盟
出口歐盟醫(yī)用口罩可通過獲得授權(quán)的公告機(jī)構(gòu)進(jìn)行查詢,其中歐盟醫(yī)療器械指令93/42/EEC(MDD)授權(quán)的公告機(jī)構(gòu)查詢地址為:
歐盟醫(yī)療器械條例EU 2017/745(MDR)授權(quán)的公告機(jī)構(gòu)查詢地址為:
(來源:騰道外貿(mào)大數(shù)據(jù))
以上內(nèi)容屬作者個人觀點(diǎn) ,不代表雨果網(wǎng)立場!如有侵權(quán),請聯(lián)系我們請聯(lián)系我們 。



