

雨果網獲悉,自4月1日起,出口新型冠狀病毒檢測試劑、醫用口罩、醫用防護服、呼吸機、紅外體溫計的企業向海關報關時,須提供書面或電子聲明,承諾出口產品已取得我國醫療器械產品注冊證書,符合進口國(地區)的質量標準要求。海關憑藥品監督管理部門批準的醫療器械產品注冊證書驗放。上述醫療物資出口質量監管措施將視疫情發展情況動態調整。有關醫療物資出口企業要確保產品質量安全、符合相關標準要求,積極支持國際社會共同抗擊疫情。
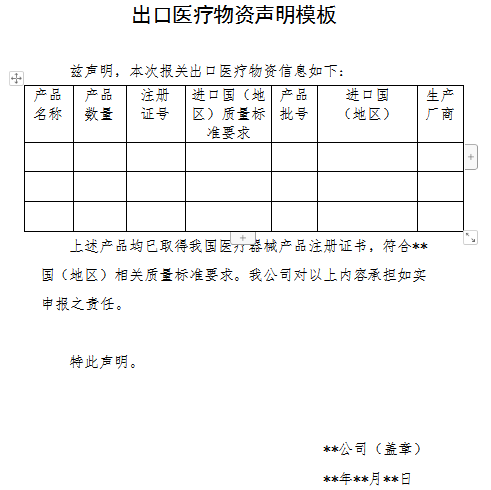
(藥監局附件截圖/出口醫療物資資質聲明)
同時,國家藥監局日前召開全面加強疫情防控醫療器械出口質量監管工作專題電視電話會議,對全系統加強疫情防控出口醫療器械質量監管工作進行再強調、再部署、再落實。會議強調,為確保我國出口5類醫療產品(新冠病毒檢測試劑、醫用防護服、醫用口罩、呼吸機、紅外體溫計)需要取得藥監部門出具的醫療器械產品注冊證書“新政”的落實,會議提出了5個方面的保障措施:
一是要迅速摸清企業情況,確保監管突出重點。各省級藥品監管部門要建立出口醫療器械企業清單,實行動態調整,對醫療器械生產企業和經營企業出口醫療器械產品,做到心中有數;監督指導出口企業完善出口產品檔案,切實保證產品出口過程的可追溯;及時將出口企業清單通報企業所在地政府。
二是確定專人負責上報,確保信息公開質量。國家局已將藥品監管部門批準注冊的5類醫療產品在國家藥監局網站持續集中公開;各省級藥品監管部門要指定專人負責信息上報。
三是準確把握法律定位,規范出口銷售證明。對未在我國取得醫療器械注冊證書及生產許可證書、或者未辦理醫療器械產品備案及生產備案的企業,一律不得出具出口銷售證明。
四是組織系統精干力量,加大監督檢查力度。各省級藥品監管部門要迅速調集全省資源,建立醫療器械生產經營企業清單制和監管人員責任制,針對重點對象,圍繞關鍵環節,聚焦突出問題,強化控制措施,凡是有證據表明出口產品質量存在問題的,要立即停產、整頓,并查清問題。問題未查實、責任未分清的,不得恢復生產、經營。
五是突出出口產品監管,強化監督抽檢力度。各省級藥品監管部門要根據疫情防控需要和保障出口產品質量的需要,適當調整抽檢項目。抽檢要涵蓋本省企業生產的各類產品,尤其是疫情防控期間新批準企業生產的產品。
據悉,國家藥監局將與市場監管總局相關司局,組成聯合督導組,赴部分疫情防控醫療器械出口量較大的地區進行專項督導,并將各地疫情防控醫療器械出口產品質量監管納入年度考核評價。
消息來源:國家藥品監督管理局