

近期,全球疫情備受關注,很多外貿企業咨詢口罩出口的詳細要求及各國口罩準入條件,圈妹在此收集整理了海關總署及廣東省市場監管局下屬的廣東省WTO/TBT通報咨詢研究中心等單位發布的相關資料,在此分享給各位。
主要內容分為三部分:
1、口罩出口通關提示
2、口罩出口前準備
3、各國口罩準入條件
出口通關提示
報關前提條件:
收發貨人注冊編碼(慈善機構可為臨時編碼),需辦理無紙化通關法人卡
出口資質:
口罩出口對生產銷售單位、境內發貨人,除滿足國內生產、市場流通資質需求外,中國海關無特殊資質要求。
出口申報要求:
1.商品歸類:除特殊情況外,絕大部分口罩應歸入稅號63079000。
2.檢驗檢疫:口罩為非法檢產品,申報時檢驗檢疫項目無需填報。根據我國政府與相關國家簽訂的政府間檢驗協議,對出口伊朗等少數幾個國家的產品需按規定進行裝運前檢驗。
3.關稅征免:如出口物資為貿易性質,征免性質申報一般征稅,征免方式申報照章征稅;如為捐贈性質,境內發貨人為貿易代理商、慈善機構等,征免性質可不填,征免方式申報全免。
4.禁限管理:目前商務部未對口罩設置貿易管制要求,中國海關也無針對防護物資的監管證件口岸驗核要求。
5.申報規范:按照規范申報要求填寫商品名稱、成分含量;如物資非中國生產,原產國按照實際生產國填寫。
出口退稅:
口罩的出口退稅率為13%。
中美關稅排除加征:
美國企業可申請排除口罩進口加征關稅,但是目前只有少數企業獲準豁免。詳見美國貿易代表辦公室網站https://ustr.gov/。
快速通關保障:
物資出口申報如遇單窗等系統故障,可聯系現場海關采取應急方式處置,或者撥打海關12360熱線進行咨詢。
出口前準備
以下內容是根據國內外相關政府機構、專業網站、新聞報道收集整理而成,僅供參考。具體內容以相關管理部門、國外官方機構要求為準。
明確口罩分類:
國外按照用途一般分為個人防護和醫用兩類口罩。
國內出口貿易企業需具備的資質和材料:
1.營業執照(經營范圍有相關經營內容)。
2.企業生產許可證(生產企業)。
3.產品檢驗報告(生產企業)。
4.醫療器械注冊證(非醫用不需要)。
5.產品說明書(跟著產品提供)、標簽(隨附產品提供)。
6.產品批次/號(外包裝)。
7.產品質量安全書或合格證(跟著產品提供)。
8.產品樣品圖片及外包裝圖片。
9.貿易公司須取得海關收發貨人注冊備案。
國內出口口罩生產企業資質證明:
生產個人防護或者工業用非醫療器械管理的普通口罩,有進出口權的企業,可自行直接出口。
生產屬于醫療器械管理的口罩用于出口,中國海關不需要企業提供相關資質證明文件,但一般進口國會要求生產企業提供產品三證,以證明該進口的商品在中國已合法上市,具體如下:
1.營業執照(經營范圍包含有醫療器械相關,非醫療級別的物品不需要)。
2.醫療器械產品備案證或者注冊證。
3. 廠家檢測報告。
生產企業有進出口權,可以自行出口,如沒有進出口權,可以通過外貿代理進行出口銷售。
內貿企業做出口需要取得的基本資質:
1. 向市場監管部門取得營業執照,增加經營范圍“貨物進出口、技術進出口、代理進出口”。
2. 向商務部門取得進出口權,可直接在商務部業務系統統一平臺(http://iecms.mofcom.gov.cn/)申請,網上提交材料。
3. 向外匯管理局申請取得開設外匯賬戶許可。
4. 辦理進出口貨物收發貨人海關注冊登記。
各國口罩準入條件(產品準入條件)
美國
1、必要資料:提單,箱單,發票。
2、個人防護口罩:必須取得美國 NIOSH檢測認證,即National Institute for Occupational Safety and Health美國國家職業安全衛生研究所認證。
3、醫用口罩:須取得美國FDA注冊許可。
4、監管及出口須知:
據路透社報道,美國貿易代表處3月12日宣布,不對部分從中國進口的醫藥品加征關稅。
這些醫藥品包括口罩、聽診器、血壓計袖帶等。
這一決定出于目前新冠疫情正在對美國健康醫療體系造成沖擊。此前美國貿易代表處已將洗手液、醫用手套等進口產品移出征稅清單。
① FDA監管措施
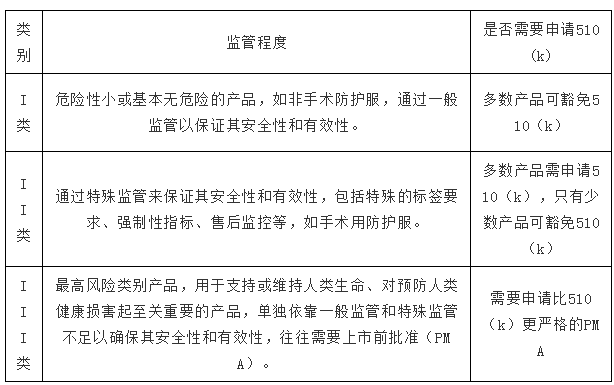
FDA根據風險等級將醫療器械產品分為3個監管控制類別,涵蓋近6000個產品代碼(product code),根據不同的風險采取相應的監管力度。
不同類別醫療器械的監管措施:
FDA 510(k)又稱上市前登記(Premarket Notification),是向FDA提交的上市前報告。FDA 510(k)的實質是證明器械的實質等同。
根據FDA的要求,少數I類和大部分II類醫療器械在美國上市前,至少需要提前90天遞交510(k)申請,用于證明要銷售的器械至少與已合法銷售的器械(即等價器械)一樣安全有效[21 CFR 807.92(a)(3)]。
在申請者收到FDA聲明器械“實質性等同”(SE)的信件格式指令之前,不可在美國銷售該器械。
510(k)的申請材料必須包括諸如產品代碼、標簽、器械技術特性的總結、測試結果等其他的資料。510(k)沒有固定的表格或者模板,但是所有的信息必須符合《聯邦法規》第21篇第807節中的要求。
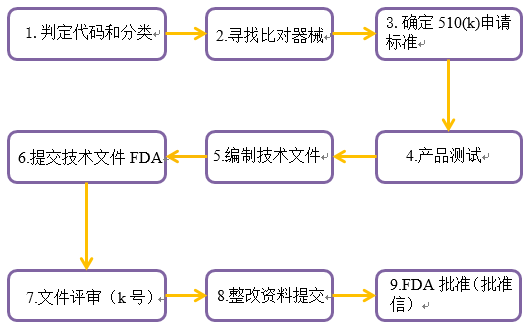
FDA 510(k)申請大致流程
如果FDA確定器械不是等價器械,申請者可以遞交另一份含有新數據的510(k)文件,提出重新分類請求,或者遞交上市前批準申批。
在FDA系統中對于口罩的分類代碼有如下3個。其中一個是外科口罩,一個是兒科口罩,一個是帶有抗菌/抗病毒介質的外科口罩。
三個類別的口罩都屬于規則878.4040,分類都是Ⅱ類,都需要申請510(k)。
FDA不測試口罩,由申請者向FDA提供檢測數據和產品宣稱性能用于審核,檢測內容包括顆粒過濾效率(PEF)、細菌過濾效率(BFE)、液體阻隔性、阻燃性等。510(k)申請周期較長,還有以下兩種可選路徑:
a)已經獲得NIOSH批準的N95口罩可以直接注冊
可以看出,如果制造商的N95口罩獲得了NIOSH的批準,生物學測試、阻燃測試和血液穿透測試都通過了,那么則可以豁免510(k)的,可以直接進行工廠注冊和器械列名。
b)獲得持有510(k)的制造商的授權,作為其代工廠使用其510(k)批準號進行企業注冊和器械列名。
申請方需要獲得授權書,需要簽署正式的質量協議,FDA會進行核實和抽查。如果使用未經許可的號碼,將會導致產品召回的風險。
② NIOSH認證
醫用口罩需要申請FDA 510(k)“上市前登記”。呼吸防護口罩則需要通過NIOSH認證,由NIOSH下屬的NPPTL實驗室實施認證。
口罩在出口美國之前,一般選擇先做NIOSH認證,再做FDA認證,產品將更受美國市場歡迎。如醫用N95口罩,需要既滿足NIOSH對于N95口罩的要求,同時也要滿足FDA相關標準。
NIOSH認證的流程如下:
1)提交申請書、技術資料(通常包括產品圖紙、產品說明、質量體系文件、測試報告等)和樣品;
2)美國實驗室執行測試與評估,NIOSH頒發證書和標簽;
3)生產商使用標簽。
NIOSH規定單獨的過濾式呼吸防護口罩上必須具有以下標識:
1)NIOSH認可的批準持有人/制造商名稱,注冊商標或申請人/批準持有人的企業名稱縮寫。如果適用,批準持有人對呼吸防護口罩進行私有標記的實體名稱可以代替NIOSH認可的批準持有人的業務名稱,注冊商標或批準持有人的業務名稱的縮寫;
2)NIOSH的大寫或NIOSH徽標;
3)NIOSH測試和認證批準號,例如TC-84A-XXXX;
4)NIOSH過濾特性和過濾效率等級,例如N95、N99、N100、R95、P95、P99、P100(目前NIOSH批準的過濾式呼吸防護口罩的七種類型);
5)型號或零件號:批準持有人的呼吸器型號或零件號,由一系列數字或字母數字標記表示,例如8577或8577A。
NIOSH建議還包括批號和/或生產日期,但這不是必需的。
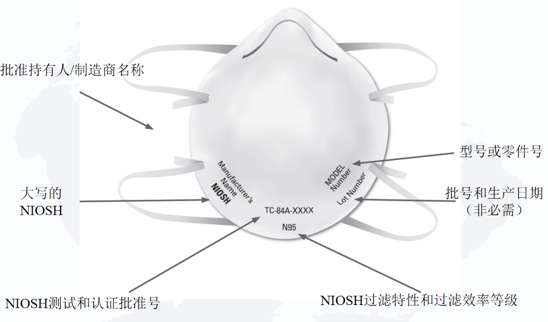
NIOSH過濾式呼吸防護口罩標識
歐盟
1、必要資料:提單,箱單,發票。
2、個人防護口罩:個人防護口罩的歐盟標準是EN149,按照標準將口罩分為FFP1/FFP2和FFP3三個類別。所有出口歐盟的口罩必須獲得CE認證證書。CE認證是歐盟實行的強制性產品安全認證制度,目的是為了保障歐盟國家人民的生命財產安全。
3、醫用口罩:醫用口罩對應的歐盟標準是EN14683。產品在歐盟銷售需要出具歐盟自由銷售證書 Free Sale Certificate,有了CE標志并進行了相關指令中要求的歐盟注冊后,中國的制造商出口歐盟不需要自由銷售證書。
4、監管及出口須知:
① 呼吸防護口罩
呼吸防護口罩需要滿足法規(EU) 2016/425的要求,防護口罩屬于其中復雜設計的產品。出口歐盟需要授權的公告機構(NB)進行認證并頒發證書,認證流程為:
a)提供申請表、產品實物圖片及說明書;
b)準備產品型式試驗報告。(依據EN 149檢測);
c)技術文件評審(由發證機構評審);
d)工廠質量體系審查(由發證機構評審工廠體系資料);
e)公告機構頒發CE證書。
② 醫用口罩
醫用口罩產品可分為無菌或非無菌狀態,其認證模式不一樣。
非無菌狀態認證:
a)編制技術文件(TCF);
b)提供測試報告(依據EN 14683要求檢測,或提供熔噴布性能測試報告和無紡布生物學測試報告);
c)編制產品符合性聲明(DoC);
d)指定歐盟授權代表并完成歐洲注冊。
無菌狀態認證:
a)滅菌驗證;
b)建立ISO 13485醫療器械質量管理體系;
c)編制技術文件(TCF);
d)提供測試報告(依據EN 14683要求檢測,主要提供細菌過濾效率、呼吸阻力、防濺阻力及滅菌驗證報告等);
e)公告機構(NB)審核;
f)獲ISO 13485證書和CE證書;
g)指定歐盟授權代表并完成歐洲注冊。
從目前整體情況來看,如果之前沒有獲得公告機構的CE證書,現在臨時申請周期比較長。因此,企業可考慮出口非無菌醫用口罩。但是非無菌醫用口罩并不是對生產環境完全無限制,EN 14683對于產品的初始污染菌要求不大于30 cfu/g。
日本
1、必要資料:提單,箱單,發票,日本國外的制造商必須向PMDA注冊制造商信息。
2、口罩包裝要求:
包裝上印有ウィルスカット(中文翻譯:病毒攔截)99%的字樣
PFE:0.1um微粒子顆粒過濾效率
BFE:細菌過濾率
VFE:病毒過濾率
3、口罩品質標準:
1) 醫用防護口罩:符合中國GB 19083-2010 強制性標準,過濾效率≥95%(使用非油性顆粒物測試)。
2)N95口罩:美國NIOSH認證,非油性顆粒物過濾效率≥95%。
3)KN95口罩:符合中國GB 2626 強制性標準,非油性顆粒物過濾效率≥95%。
4、監管及出口須知:
由于非工業用口罩沒有關于性能的鑒定規范,會造成口罩的標識和廣告的內容差異較大而給消費者帶來巨大誤解的情況。
為此,日本口罩行業協會于2006年1月制定并實施了關于口罩的“標識和廣告自愿性標準”,并呼吁所有協會會員的口罩制造商從保護消費者的角度出發,履行其社會責任。
日本全國口罩行業協會的會員標志如下:

JHPIA對口罩的標識和廣告的規定,不得在口罩的容器、外包裝以及廣告上聲稱以下內容:
①聲稱具有醫療用品方面的功效和效果,聲稱具有醫藥品、藥妝、化妝品、醫療器械的功效和效果;
②缺乏依據聲稱口罩濾料的收集效率數值的標識(但是,在有依據的情況下,可在標識出檢測方法或者檢測機關的前提下標識該數值,收集效率最高為99%)。
統一框內標識格式如下:

韓國
1、必要資料:提單,箱單,發票,韓國進口商營業執照。
2、個人防護口罩標準:KF (Korean filter) 系列分為KF80、KF94、KF99
3、執行標準規范:MFDS Notice No. 2015-69
韓國醫療器械準入的法規門檻,基本分類為I、II、III、IV類,持證為韓國公司(License holder),韓國收貨人需要到韓國藥監局Korea Pharmaceutical Traders Association. 提前備案進口資質(沒有不行)網址:www.kpta.or.kr。
4、監管及出口須知:
根據《藥品事務法》,醫藥輔品是指與疾病的治療和預防有關的產品,并由食品藥品安全局局長指定的,用于治療,減少,治療或預防人類或動物疾病的紡織品和橡膠制品、對人體無害或不直接影響人體的產品以及用于滅菌,殺蟲劑和類似目的的產品以預防傳染病的產品。
在韓國,這一分類下的物品有:口罩(手術用、衛生保健用)、用于保護、處置患處的產品(如:眼罩、繃帶、紗布等)、衛生巾、口腔衛生用品、直接用于人體外部消毒劑(如洗手液)等。
醫藥輔品上市/進口前需先向食品醫藥品安全評估院或地方食品醫藥品安全廳進行申請許可。
根據《醫藥輔品的批準、通知、評價規定》,在初次申請衛生口罩的認可時,應提供測試結果作為支持數據。指定準藥物范圍-執法20211001食品藥品安全部公告2019-86-2019年9月30日部分修訂額定值的泄漏率不得大于25.0%,KF94額定值的泄漏率不得大于11.0%,KF99額定值的泄漏率不得大于5.0%。口罩的額定值(如:KF80、KF90、K99)應在產品名稱括號中注明。
衛生口罩需并在成品上注明“按下列試驗方法進行試驗時,各單項測量值不應小于OOO%。”并在描述面部吸入阻力試驗測試方法時說明以下細節:“將標準頭部模型放置在面部區域后進行試驗。使用六個衛生口罩時,三個應與提交的一樣,另外三個應在溫度38±2.5℃和濕度85±5%RH下無人看管24±1小時,然后用作試樣。當空氣以每分鐘30升的連續流量噴過面部區域時,應測量水柱(mmH2O),并詳細說明試驗方法的其他細節。”
根據2014年9月4日的補充規定2014-153號,原本作為防塵口罩或防病口罩的產品,被允許作為公共衛生口罩。
如果得到韓國食藥廳許可,口罩會在包裝上標上 “????(醫藥輔品)”。“???(手術用)”和“???(衛生保健用)”都屬于醫藥輔品。
根據韓國海關官網2020年3月5日信息,口罩進口清關流程如下:
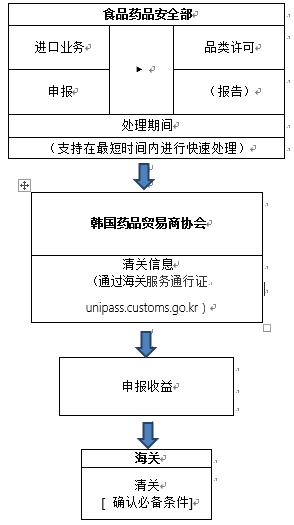
目前食品藥品安全部正在進行快速許可,許可審查部門的聯系方式如下:(聯系以獲取進口業務報關單和產品授權書,并迅速處理進口要求。 )
澳大利亞
1、必要資料:提單,箱單,發票。
2、須通過澳洲的TGA注冊,符合標準規范:AS/NZS 1716:2012,此規范是澳大利亞和新西蘭的呼吸保護裝置標準。
TGA 是Therapeutic Goods Administration的簡寫,全稱是治療商品管理局,它是澳大利亞的治療商品(包括藥物、醫療器械、基因科技和血液制品)的監督機構。澳大利亞對醫療器械分為I類,Is and Im, IIa, IIb, III類,產品的分類幾乎和歐盟分類一致,如果產品已經獲得CE標志,則產品類別可以按照CE分類。
3、監管及出口須知:
澳洲的醫用口罩按照I類管理,需要在TGA進行備案之后銷售。在澳洲的備案需要由澳洲當地的SPONSOR來完成,其合規流程為:
① 指定SPONSOR;
只有通過澳大利亞的代理人才能夠提出申請,代理人這里有一個專有名詞叫“Sponsor”,簡單來說就是進口商。
② 完成技術文檔;
低風險的I類器械沒有強制性質量體系和上市前評價的明確要求, 但要求制造商提供相關文件證明其安全有效性。
③ 提交TGA進行備案;
④ 獲得證書。
特別提醒:澳大利亞已與歐盟達成互認協議。這意味著,合格評定證書由TGA頒發的也被歐盟認可,TGA也認可歐盟CE認證。已獲CE認證的用戶,可提交CE證書及相關資料,獲得TGA證書。
提示:以上內容是根據國內外相關政府機構、專業網站、新聞報道收集整理而成,僅供參考。具體內容以相關管理部門、國外官方機構要求為準。(來源:阿里巴巴外貿圈)
以上內容屬作者個人觀點,不代表雨果網立場!如有侵權,請聯系我們。