

在疫情爆發的當口,“口罩“生意,成為關注焦點。
目前,中國疫情趨緩,歐洲、日本、韓國和意大利感染人數持續上升,伊朗則以極高的病死率引發全球關注。
民眾的不安情緒,將會將會幾何級地放大全球口罩需求。“口罩慌”將比“口罩荒”更有實際的市場效應。
在此情況下,口罩商機很快將轉移到國外。
那么口罩在歐美國家的分類、準入門檻及要求是怎樣的呢?
1、個人防護口罩
美國NIOSH
NIOSH將口罩分成N95、N99、N100、R95、R99、R100、P95、P99、P100合計9個類別。從某種意義上來說,N95算是其中防護級別比較低的品類。
上述9種口罩需滿足美國聯邦法規42 CFR Part 84的要求,主要測試指標包括呼氣阻力測試(Exhalation Resistance Test)、呼氣閥泄漏測試(Exhalation Valve Leakage Test)、吸氣阻力測試(Inhalation Resistance Test)、過濾效率測試(Sodium Chloride Test)。
認證的申請:
需按照NIOSH的指南實施,企業需寄送樣品至NIOSH實驗室實施測試,同時提交技術性資料(包括質量體系部分資料)至NIOSH文審,只有文審和測試都通過,NIOSH才核發批文。
歐洲PPE
個人防護口罩的歐洲標準是EN149,按照標準將口罩分為FFP1/FFP2和FFP3三個類別,具體的指標如下:

歐洲防護口罩分類
認證的申請:
防護口罩需要滿足歐盟個人防護設備指令(PPE)的要求,企業需選擇有PPE法規授權的公告機構(Notified body)實施申請,NB機構需審核企業質量管理體系和CE技術文檔。審核通過后可獲得PPE法規的CE證書。
2、醫用口罩
美國FDA
美國對于醫用口罩的管理機構是FDA,在FDA系統中對于口罩的分類代碼有如下3個。其中一個是外科口罩,一個是兒科口罩,一個是帶有抗菌/抗病毒介質的外科口罩,如圖所示。
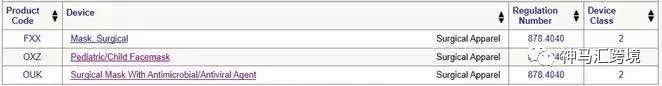
美國FDA分類數據庫中的口罩
三個類別的口罩都屬于規則878.4040,分類都是II類,都需要申請510K批準。那么我們正常出口美國的口罩必須的路徑為:
1)進行產品測試(性能測試、生物學測試)
2)準備510K文件,提交FDA評審
3)FDA發510K批準信
4)完成工廠注冊和器械列名
5)產品出口
歐洲CE
醫用口罩對應的歐洲標準是EN14683,該標準對于口罩的分類如下圖所示,按照BFE、呼吸阻抗和防噴濺能力分為三個類別,如圖所示
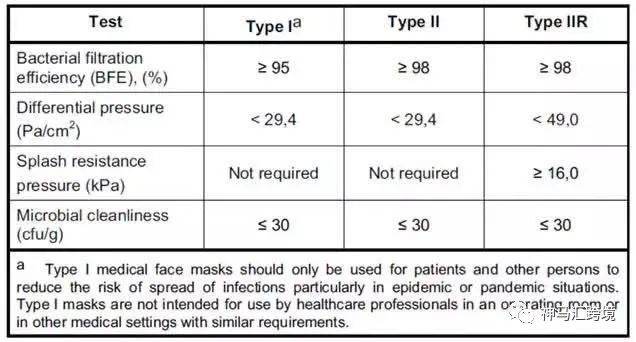
歐洲醫用外科口罩的分類
按照醫療器械法規2017/745/EU的要求,口罩產品可以按照一類器械進行管理。依據產品是無菌或非無菌狀態提供,其認證模式不一樣。(來源:神馬匯跨境)
以上內容屬作者個人觀點,不代表雨果網立場!如有侵權,請聯系我們。