

自從英國正式脫歐以后,英國醫藥保健產品監管局(MHRA)也發布了新的指導原則,宣布英國對醫療器械監管的新要求,這讓很多醫療器械制造商都面臨著既要滿足歐盟要求又要滿足英國新法規的要求的局面。大家對歐盟的MDR和英國的UKCA的區別都不是很明白,今天我們就帶著幾個問題來幫助大家理解他們的異同。
Q:
歐盟MDR法規下的CE認證可以替代英國的UKCA認證嗎?
A:
CE認證只適用于原來歐盟成員國的認證,而UKCA只是適用于英國的認證制度。所以CE認證替代不了UKCA認證的。
Q:
歐盟授權代表可以替代英國合規負責人嗎?
A:
如果之前的歐盟授權代表不是在英國注冊成立的,那您需要另外在英國任命合規負責人。換句話說,投放至歐盟國家/地區的商品需要具備CE標志及歐盟合規負責人,若同時銷售到英國,則需另外具備UKCA標志及英國合規負責人(英國授權代表)。
Q:
對于一類器械,歐盟MDR技術文件可以替代UKCA技術文件嗎?
A:
不行!歐盟MDR參照的法規是2017/745/EU,而UKCA參照的是 UK MDR 2002法規。而UK MDR 2002的實質內容更加趨同于原來的MDD 93/42/EEC及2007/47/EC的內容。所以,EU MDR文件不能替代UKCA的技術文件。
Q:
一類器械是否應分別在英國和歐盟進行注冊?
A:
取決于您產品要出口的地區。如果要出口英國地區,就需要在英國的主管當局MHRA進行UKCA注冊;如果您出口的是歐盟地區,則要在歐盟境內主管當局進行注冊。
Q:
出口到英國申請UKCA認證是必須要貼UKCA標志嗎?
A:
從2021年1月1日起,進入英國地區需要滿足UKCA要求時需要加貼UKCA標志在設備上。從2023年7月1日起將設備投放到大不列顛市場必須使用UKCA標志。同時滿足CE和UKCA要求的制造商可以對設備進行雙重標記。
Q:
出口到北愛爾蘭是做CE認證呢還是做UKCA認證呢?
A:
對于非北愛爾蘭地區的制造商,如果產品要出口到北愛爾蘭,那么你需要滿足CE認證的要求。通常應該向歐盟公告機構申請CE認證,獲得證書后才可以出口到北愛爾蘭。
對于北愛爾蘭的制造商,可以申請英國獲批準的認證機構進行認證,獲得UK(NI)證書,在愛爾蘭合法銷售。而UK(NI)的標志只能用在北愛爾蘭市場,既不會被歐盟市場接受,也不會被大不列顛市場接受。
針對上述情況,我們對于中國制造商出口需要滿足的要求進行匯總如下:
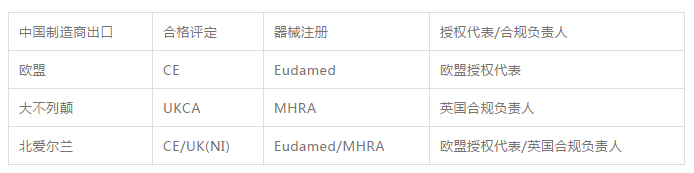
Q:
歐盟CE認證和UKCA關于器械注冊的要求是否一樣?
A:
不一樣!歐盟CE認證需要使用Eudamed數據庫來完成經濟運營者注冊和器械注冊,而UKCA制度下則是通過MHRA的APPIAN 系統來完成器械注冊。
Q:
對于需要公告機構或者UK認證機構介入的產品,其合格評定過程可以共用嗎?
A:
取決于公告機構或UK認證機構。從合格評定的內容來看,如果選擇模式趨同,評定的可能都是質量管理體系以及PMS的內容等。所以如果同一家機構具備兩個認證的資質,是有可能結合一次審核來同時完成EU MDR和UKCA的合格評定過程的。
(來源: 跨境工具人的king)
以上內容屬作者個人觀點,不代表雨果跨境立場!如有侵權,請聯系我們。